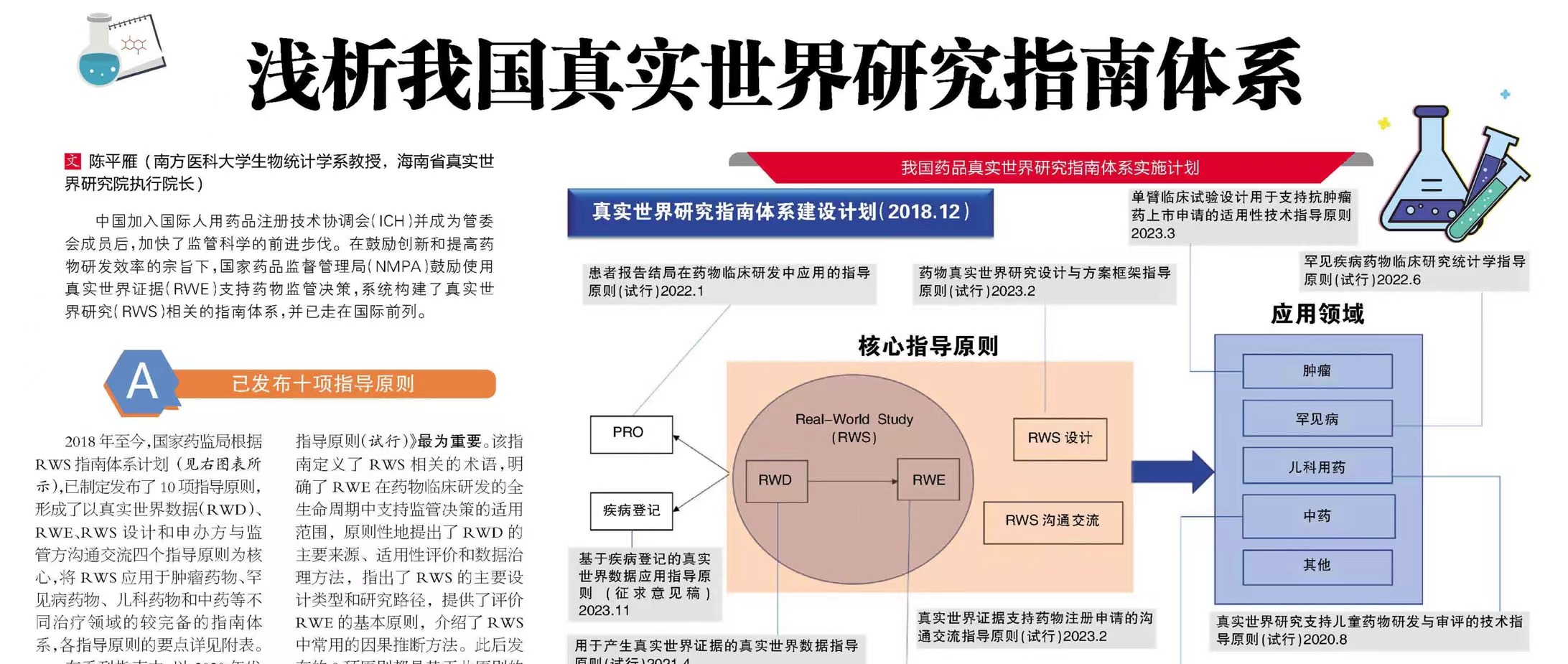


1月7日,国家药监局药审中心发布《药物临床试验随机分配指导原则(试行)》,自发布之日起施行。

1月4日,国家药监局药审中心发布《药物临床试验数据管理与统计分析计划指导原则》,自发布之日起施行。

1月4日,国家药监局药审中心发布《患者报告结局在药物临床研发中应用的指导原则(试行)》,自发布之日起实施。
12月27日,国家卫健委医政医管局发布新型抗肿瘤药物临床应用指导原则(2021年版),自发布之日起施行。

12月20日,国家药监局药审中心发布《创新药临床药理学研究技术指导原则》,自发布之日起施行。

12月20日,国家药监局核查中心发布《药品注册核查工作程序(试行)》、《药品注册核查要点与判定原则(药理毒理学研究)(试行)》、《药品注册核查要点与判定原则(药物临床试验)(试行)》

12月20日,国家药监局药审中心发布《药品注册核查检验启动工作程序(试行)》,自2022年1月1日起实施。

2021年11月26日,国家药监局药品审评中心发布了《抗肿瘤治疗的免疫相关不良事件评价指导原则(征求意见稿)》,为申办者对抗肿瘤免疫治疗临床试验中免疫相关不良事件的识别和判定提供了指导性建议。

2021年11月18日,国家药监局药品审评中心发布了《罕见疾病药物临床研究统计学指导原则(征求意见稿)》,为申办者开展罕见疾病方面的临床研究提供了在设计和统计分析等方面的指导性建议。

随着创新药的大量涌现,临床试验中的适应性设计逐渐成为热点。对此,学术界、药企、监管机构分别持有怎样的见解?

3月27日,国家药监局药品审评中心与南方医科大学战略合作所建立的三方学术协调委员会(以下简称“三方委员会”)第 16 次闭门会议在博鳌乐城先行区召开。与会专家激情碰撞,共商监管科学事业和创新药物研发,为推动真实世界数据研究等工作贡献智慧和力量。

2020年9月23日,为指导临床试验申办者建立药物临床试验数据监查委员会(Data Monitoring Committee,DMC),规范DMC的监查活动,国家药品监督管理局药品审评中心(下称药审中心)发布了与三方学术协调委员会共同起草的《药物临床试验数据监查委员会指导原则(试行)》(下称《指导原则》)。
总部:广州市黄埔区云升科学园C栋8层